生命科学
物理科学
OEM
Applications & Techniques
In-Vivo Imaging
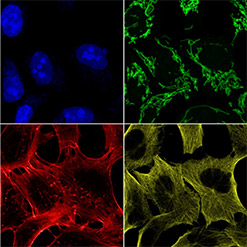
通过采集具有明显染色细胞特征的标准样本的多通道图像,验证显微镜的荧光通道激光和发射滤片是否正确匹配。
使用标准细胞玻片(GATTA-Cells 4C),60x油浸物镜,4个共聚焦通道(Confocal-Blue, Confocal-Green, Confocal-Yellow, Confocal-Red),采集多通道图像,检查每个通道图像是否存在预期的细胞结构(蓝-细胞核;绿-线粒体;黄-微管;红-肌动蛋白丝)。此外,还要检查图像中是否存在因激光-滤光片组合不正确而导致的意外荧光通道溢出或激发串扰。

通过检查标准样本的预期特征和结构,验证显微镜明场和微分相差(DPC)透射光通道是否正确激活和运行。
使用硅藻标本(Diatom Test Slide V2.0),60x油浸物镜,明场和DPC通道,设置标准的透射光强度和曝光时间。采集标本上的紫心辐节藻(Stauroneis phoneicenteron)的图像。在图像采集软件中对两幅图像进行数码缩放,检查形成硅藻条纹的网隙结构。在每张采集的图像中,沿着硅藻的纵向条纹应能分辨出12-15个单独的网隙孔,则明场和DPC图像通道工作正常。
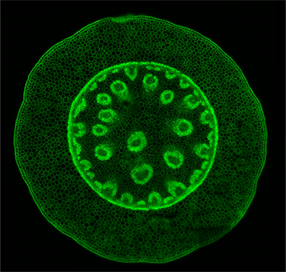
正常运行的显微镜电动XY载物台应能够在大型样本上准确采集多个视野的拼接图像,而最终拼接的图像中不会出现任何明显的不连续伪影。
使用自发荧光的标准铃兰植物横切玻片,60x油浸物镜,Confocal-Green通道。将样本聚焦并平移到其中心。执行Montage拼接采集程序,然后使用图像采集软件的自动图像处理功能将获取的各个视野拼接在一起。对最终拼接图像进行数码缩放和目视检查。最终图像没有任何明显的不连续伪影,说明XY载物台功能正常。

通过采集具有预期三维结构的合适的荧光样品的Z轴扫描图像,验证显微镜的Z方向功能是否正常。使用自发荧光的标准黄曲霉菌玻片,60x油浸物镜,Confocal-Yellow和Confocal-Red通道,设置标准的图像采集参数。在图像采集软件中执行Z轴扫描程序,实时渲染生成样本的三维图像。对最终的三维图像进行数码缩放,并目视检查圆柱形分生孢子茎的呈现状态是否符合预期,这些分生孢子茎末端位于单个球形的分生孢子囊泡(有丝分裂孢子)。

精确的图像强度测量可以用来推断样本间的荧光探针相对浓度,这要求显微镜长时间并重复使用时,提供稳定且一致的激光功率。如果光学器件未对准或受污染、激光器或相关电子器件故障,会造成仪器输出的激光功率与预期有明显偏差。因此,为了确保激光功率通量稳定和荧光强度可靠,定期测量显微镜系统的激光功率非常重要。
使用经过校准的荧光塑料玻片,2x物镜,设置标准的图像采集参数,预热1小时后,测量图像光强,可以间接推测每个宽场荧光通道(EPI-Blue、EPI-Green、EPI-Yellow、EPI-Red)到达物镜后孔径的最大输出激光功率(软件中设为100%)。使用该荧光塑料玻片的校准常数,可以将每个通道整个视野的平均像素强度转换为绝对激光功率P(以毫瓦为单位)。
如果各个荧光通道换算得出的激光功率等于或大于规定值,则该测试通过。
在共聚焦针孔转盘、照明匀光器和仪器所有的冷却风扇正常旋转的情况下,相机设置为最大帧速率,使用显微镜的绿色宽场荧光通道(EPI-Green)采集单个直径1微米的固定荧光微球的延时图像序列。然后将图像序列导入ImageJ,并使用Trackmate插件以亚像素定位精度确定每帧中微球的横向XY位置坐标。从时间序列数据中提取微球位置沿X和Y方向的标准偏差,表示为径向组合标准偏差σxy。
要通过系统振动测试,径向标准偏差必须小于或等于规定的图像运动最大阈值。如果系统振动测试失败,Andor现场服务工程师将协助客户隔离并移除任何外部振动源。
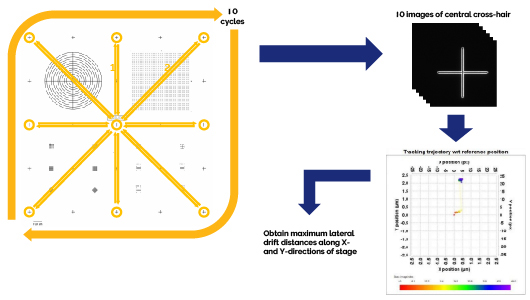
想要精准采集样本的拼接图像和多视野成像,同时消除载物台移动伪影,就要求XY载物台在反复长距离移动后仍然能够精确定位。载物台重新定位的误差来源包括环境条件(如温度变化和气流)和XY载物台马达故障。
使用Argo-HM标准片,60x油浸物镜,Confocal-Blue通道,对中心十字准线聚焦,执行自动图像采集程序,XY载物台依次移动到标准片边缘的其他8个十字准线(上、右上、右、右下、下、左下、左、左上),在移到每个边缘的十字准线后都会返回中心十字准线,然后再移动到采集序列中的下一个十字准线。进行10次这样的循环,软件中XY载物台路线坐标保持不变,每个完整往返周期后,都会采集一张中心十字准线的图像。将中心十字准线的10张图像导入Argolight的Daybook软件,进行载物台定位重复性分析,相对于第一个中心十字准线图像位置,测量沿X和Y方向的最大横向漂移距离(Max |Driftxy|,以微米为单位)。
沿两个轴向的最大横向漂移幅度必须等于或小于规定值,才能通过载物台准确性和重复性精度测试。
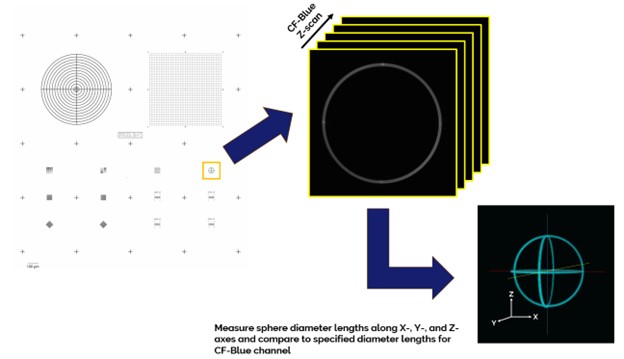
想要真实、准确的展示样本的三维形状,就需要显微镜的物镜聚焦驱动能够沿着Z方向进行精细切分和精确的机械步进。
如果聚焦驱动故障,无法重复或准确的追踪Z轴步进量,会导致Z方向的样本结构被拉长或压缩,从而导致图像内部/图像之间的距离、体积或跨通道对象空间和形态关系不正确。
显微镜的聚焦驱动性能可以通过以下方法测量:使用Argo-HM标准片的经络球体图形(Pattern G),60x油浸物镜,Confocal-Blue通道,设置标准的Z步进大小,采集球体的Z扫描图像。然后使用Argolight的Daybook软件进行三维重建精度测试,分析沿X、Y和Z轴方向的经线测量长度与规定长度的比值G。
沿各轴线的实测比值必须在规定范围内,才能通过3D重建测试。
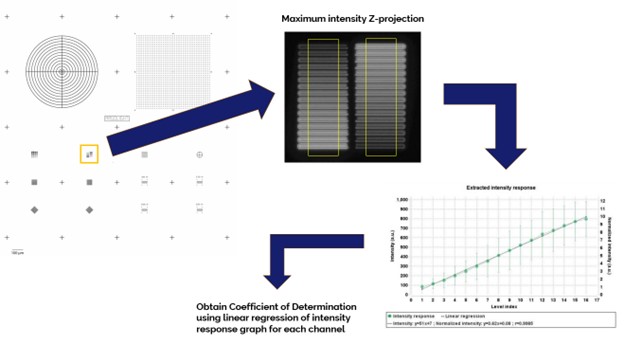
荧光显微镜的光强响应是指检测器对输入光子通量转化为输出数字信号。理想情况下,光强响应是线性的,因此可以从空间和时间上准确监测样本中的真实荧光信号。
随着时间的推移,光强响应的任何变化,可能代表探测器灵敏度下降、标定失准或探测器即将失效。
测量成像系统的光强响应:使用 Argo-HM校准片的2×16强度阶梯图形(Pattern D),60x油浸物镜,Confocal-Green通道,对图形进行Z扫描。然后使用Argolight的Daybook软件进行强度响应测试,通过线性回归计算样本可决系数R²int。
测得的样本可决系数必须等于或大于规定值,光强响应测试才算通过。

灰尘和其他颗粒物会沉降并积聚在显微镜的光学表面上。在不同的成像模式下,这些污染物可能会在图像背景中显示为或亮或暗的点、线或其他各种图案,这些图案会叠加在实际样本的图像上,妨碍对各种成像参数进行准确的量化,并产生视觉干扰,分散和转移人们对图像本身特征的注意力。
随着时间的推移,背景中会出现这种亮/暗的静止伪影,并且不会随着XY载物台或Z聚焦而移动,这表明光学元件可能受到污染或损坏,需要清洁或更换,但首先要将这些背景特征与仪器制造时检测和记录的各种光学元件的自然划痕和凹痕区分开来。例如,在共聚焦荧光图像的深色背景上新出现的明亮弧线说明有小荧光粒子落在旋转的针孔盘上,而在明场透射光图像的明亮背景上出现明显的暗弧很可能是由于非荧光颗粒阻塞了针孔转盘的单个针孔。在共聚焦荧光图像的背景中观察到模糊的“雾霾”可能是由于自发荧光或某个光学器件上的荧光污染物造成的。
评估仪器污染和背景伪影:在不放置样本的情况下,使用不同成像模式(明场、DPC、宽场和共聚焦荧光——所有通道),设置标准的图像采集参数,进行亮/暗背景测试。记录这些空白视野中存在的任何明暗特征的大小、形状和位置,然后与制造时使用相同成像条件获得的相应图像进行比较。任何超过一定大小且原始出厂图像中不存在的新特征都被是污染物或光学表面的损伤,必须通过比较空背景信号和预置的背景伪影强度阈值调节来解决。
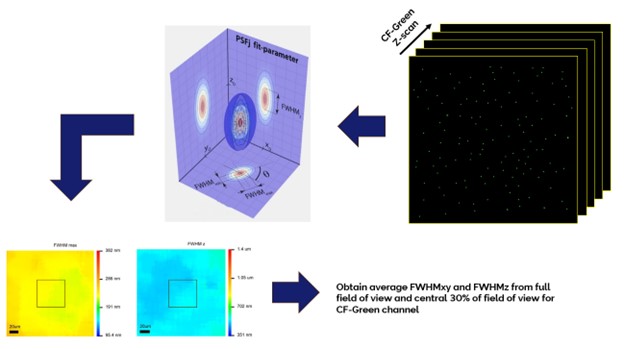
荧光显微镜的图像分辨率决定了测量样本微小结构的三维尺寸的精确度,以及可以明显相互区分开来的微小结构的最小体积。总体而言,成像系统的分辨率还可以量化图像的清晰度质量,它不仅取决于成像通道相关的波长,还取决于所有分析限定的视野范围。通过测量点状荧光物体(例如小荧光微球)的发射光在该物体的图像中扩散并最终变得模糊,来确定系统X、Y和Z方向上的点扩散函数 (PSF) ,可以确定分辨率。
如果系统的XY和Z分辨率偏离理想值,表明光学器件可能未对准、污染或损坏,或者可能是因为物镜本身固有的光学像差。
使用60x油浸物镜,Confocal-Green通道(488 nm 激发;529 nm 发射),设置标准的图像采集参数,采集至少一百个直径200nm的绿色荧光微球的Z扫描图像。该样本的荧光微球应均匀分布在整个视野,使用170μm的玻璃盖玻片固定。将数据导入PSFj1,并使用标准参数进行分析,与全视野和中心30%视野的范围内微球椭球模型剖面值拟合 ,分别得到横向平均半高宽最大值 (FWHMxy) 和轴向平均半高宽最大值 (FWHMz)。
该测试使用200 nm的微球,是因为与亚衍射尺度的微球相比,它们的信号强度更高。PSFj通过反卷积算法计算测试对象的大小,并生成与大小无关的分辨率参数。
如果测得的横向和轴向FWHM值等于或小于规定值,则视为PSF测试通过。Faklaris等人2 定义了FWHMxy/resox/y和FWHMz/resoz数值,其经验公差值为1.5 (测试了100多个物镜)。
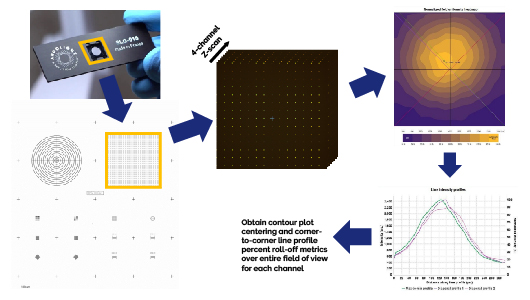
为了后续的图像分析,需要对整个视野进行准确的光强测量,以及对图像结构或亚细胞成分进行适当的阈值化和分隔,这要求显微镜的照明分布和感光分布(统称为系统均匀性分布)在整个图像中尽可能居中且均匀。 不均匀性的来源包括未对准的光路或光学检测器件,以及物镜本身固有的横向色差,这些色差导致荧光发射光通过共聚焦转盘相应的激发针孔时偏离中心和/或散焦。后一种效应在视野边缘观察时最为明显。
使用Argo-HM标准片上的圆点场图形(Pattern B),60x油浸物镜,通过4通道((Confocal-Blue, Confocal-Green, Confocal-Yellow, Confocal-Red)采集全视野的Z扫描图像。 将图像数据导入到Argolight的Daybook软件中,进行视场均匀度测试,分析每个通道消除背景后的Z投影最大光强。 图像中每个圆点的平均光强度用于生成均匀度分布等线图,从中获得照明对中准确度*C 和对角(左上到右下、右上到左下)衰减百分比数值。以100%减去每个对角线测量的衰减百分比数值,得到每个通道的均匀度值*U(与Faklaris等人1定义的数值相同的C-U,以及ISO 21073:2019 norm: Microscopes — Confocal microscopes — Optical data of fluorescence confocal microscopes for biological imaging)。
Confocal-Blue通道测得的对中准确度必须等于或大于规定值,每个通道的两个对角分布均匀度值都必须等于或大于规定值。 满足这些条件,则视为通过系统均匀性和照明对中测试。
注意:得益于Andor的Borealis™技术,其他3个共聚焦通道(Confocal-Green, Confocal-Yellow, Confocal-Red)的照明分布非常均匀,导致使用Argolight的Daybook软件对这些通道很难进行照明对中分析。因此,对中测量仅针对Confocal-Blue通道进行。

精确的图像强度测量可以用来推断样本间的荧光探针相对浓度,这要求显微镜长时间并重复使用时,提供稳定且一致的激光功率。如果光学器件未对准或受污染、激光器或相关电子元件故障,会造成仪器输出的激光功率与预期有明显偏差。因此,为了确保激光功率通量稳定和荧光强度可靠,定期测量显微镜系统的激光功率非常重要。
使用经过校准的荧光塑料玻片,2x物镜,设置标准的图像采集参数,预热1小时后,测量图像光强,可以间接推测每个宽场荧光通道(EPI-Blue、EPI-Green、EPI-Yellow、EPI-Red)到达物镜后孔径的最大输出激光功率(软件中设为100%)。使用该荧光塑料玻片的校准常数,可以将每个通道整个视野的平均像素强度转换为绝对激光功率P(以毫瓦为单位)。
如果各个荧光通道换算得出的激光功率等于或大于规定值,则该测试通过。
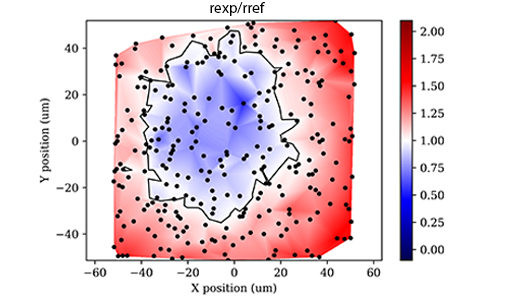
色差校正准确度代表荧光显微镜正确呈现多色样本图像的能力。一台具有完美色差校正的仪器可以在所有通道展示多色样本在三维空间中的完美重叠。然而,系统中光学器件的缺陷(主要来自物镜本身)往往会在通道之间产生微小的图像放大倍率差异(横向色差-LCA)和与通道颜色相关的焦距差异(轴向色差-ACA),从而导致各通道之间的图像出现一定程度的配准错误。在整个视野内,这些色差通常也存在空间变化,最严重的配准错误通常出现在图像角落。
在对多色荧光标记样本进行定量的跨通道共定位分析或荧光强度对比研究时,需要避免对所研究样本结构的错误描述或对样本染色结构之间的生物关系误解,因此了解各通道之间在横向和轴向的校正精度至关重要。
对于LCA,使用Argo-HM标准片上的圆点场图形(Pattern B),60x油浸物镜,通过4通道(Confocal-Blue, Confocal-Green, Confocal-Yellow, Confocal-Red)采集Z扫描图像。使用Daybook软件对图像数据进行横向校正准确度测试,得到不同颜色通道的组合(蓝-绿、绿-黄和绿-红)横向色差的二维空间(XY)热力图,根据通道组合的图像中相应圆点之间的矢量距离大小进行颜色编码。在全视野和中心30%视野的热力图范围内,每组通道的LCA记录为最大横向分离矢量距离 Max |rxy|。
对于ACA,使用同一个60x油浸物镜,对均匀分布的直径1μm的多色荧光微球进行4通道共聚焦Z扫描。将图像数据导入PSFj1 (双通道分析模式),并使用标准参数进行分析,得到轴向色差热力图,该热力图绘制了与LCA分析中相同的通道组的每个微球之间的轴向距离。在全视野和中心30%视野的热力图范围内,每组通道的ACA记录为整个热力图的平均轴向分离距离Avg |rz|。
只有当测得的横向和轴向分离距离等于或小于每组通道对应的规定值时,色差校正测试才算通过。为便于参考,另外列出了根据这些规定的分离距离计算出的等效校正比值(rexp/rref)。同样,根据测得的分离距离计算出的比值也必须小于每组通道对应的规定比值。
OQ服务提供了校正比值的空间热力图,使研究人员能够确定共定位可靠的区域,以设计准确度最高的共定位实验。
 公安机关备案号31010402003473
公安机关备案号31010402003473